Autor: Rodríguez García El
Cita: slanh.net/red-ira/ Abr 2024
Visual: Rodríguez García El
@goldenglom
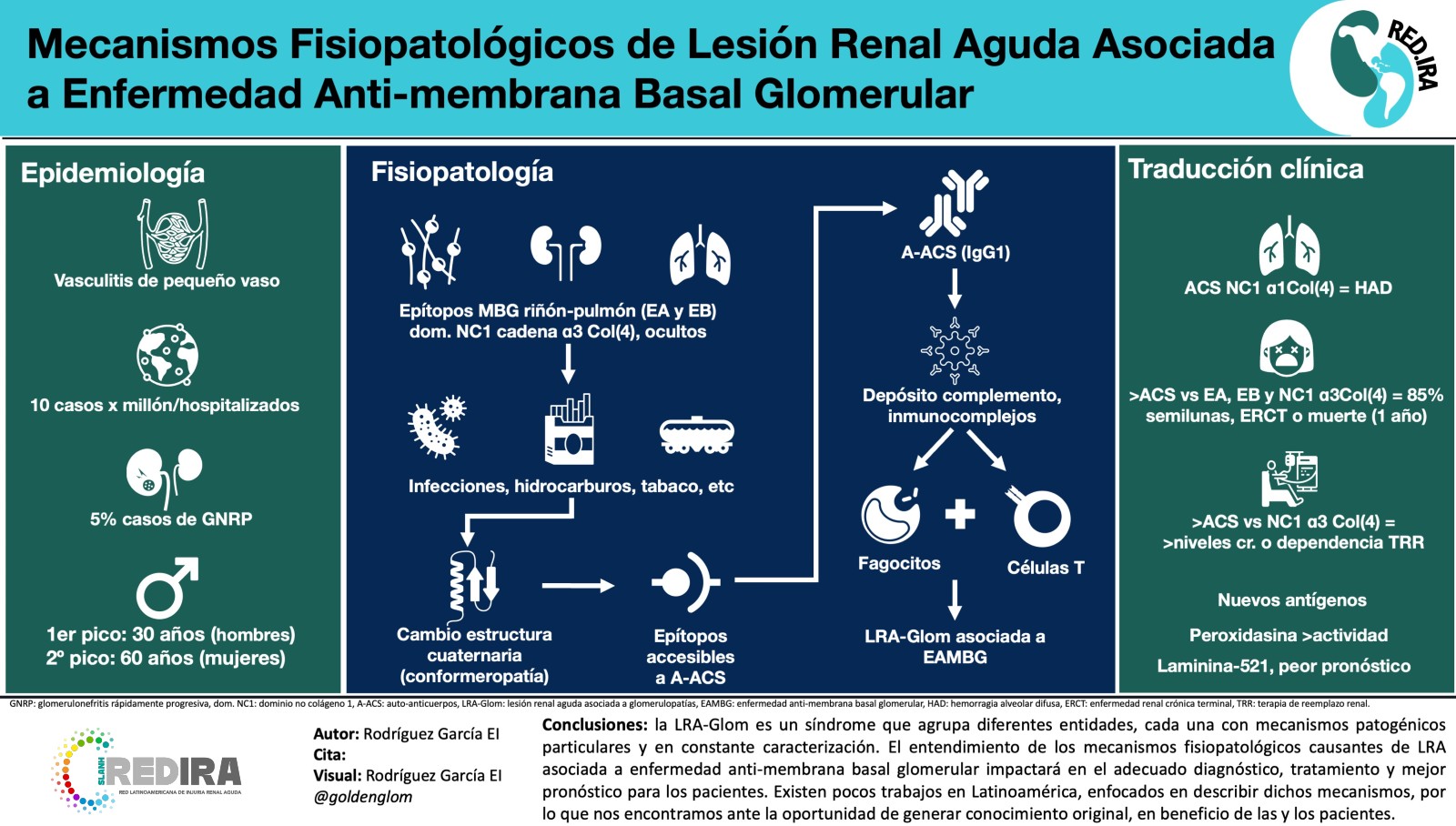
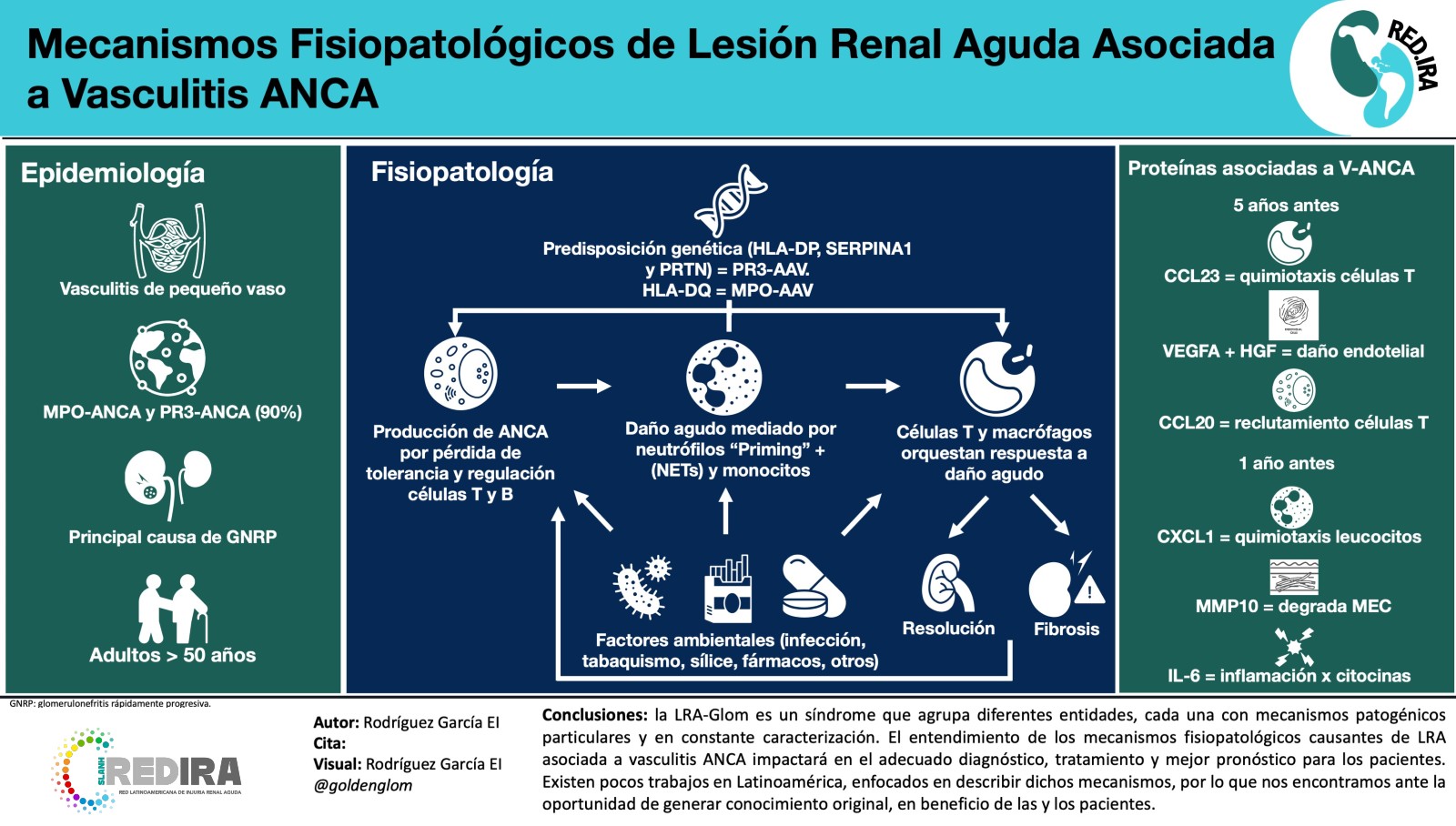
Descargar Artículo ➜Conclusiones: La LRA-Glom es un síndrome que agrupa diferentes entidades, cada una con mecanismos patogénicos particulares y en constante caracterización.
Resulta de suma importancia para el campo de la nefrología el entendimiento de los mecanismos fisiopatológicos causantes de LRA asociada a enfermedad anti-membrana basal glomerular y asociada a ANCA, pues esto impactará en el adecuado diagnóstico, tratamiento e impacto pronóstico para los pacientes.
Gracias a los avances en los métodos y estudios para el conocimiento de la fisiopatología de la LRA-Glom, actualmente contamos con una descripción molecular más precisa de las diferentes vías y mecanismos de daño, lo cual ha impactado en mejorar el arsenal terapéutico disponible, sin embargo debemos considerar que en Latinoamérica existen pocos trabajos enfocados en describir dichas vías por lo que nos encontramos ante la gran oportunidad de generar conocimiento original, en beneficio de las y los pacientes.