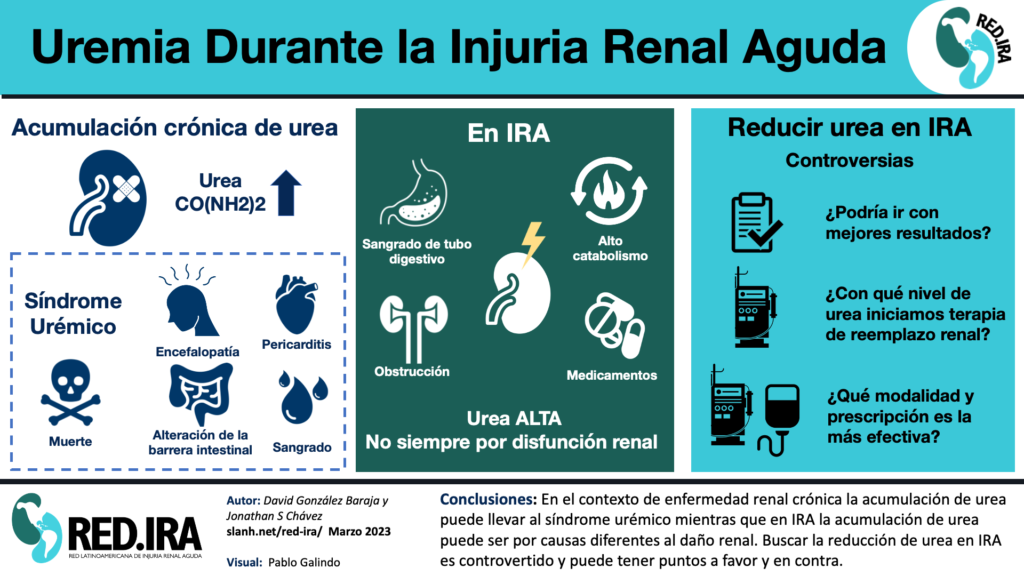
Uremia Durante la Injuria Renal Aguda
David González-Barajas y Jonathan S. Chávez-Íñiguez
Nephrology Service, Hospital Civil de Guadalajara Fray Antonio Alcalde, Guadalajara, Jalisco. Mexico. University of Guadalajara Health Sciences Center, Guadalajara, Jalisco. Mexico.
La injuria renal agua (IRA) se caracteriza por la diminucion en la funcion de las cualidades principales del riñón, como la excrecion de solutos, toxinas y volumen [1]. Una de las funciones principales del riñón es excretar productos de desecho generados durante el metabolismo, manteniendo el medio interno en homeostasis. Uno de los principales productos de desecho del metabolismo es la urea (también conocida como carbamida). Es un compuesto orgánico volátil con la fórmula química CO(NH2)2, que es el producto final del metabolismo de las proteínas y el nitrógeno. La urea se encuentra en concentraciones muy altas en la sangre de pacientes con enfermedad renal [1] y ésta empeora al disminuir aun más la tasa de filtrado glomerular. Debido a esta correlación, las anomalías metabólicas que se presentan en este contexto se denominan “síndrome urémico” [2]. El síndrome urémico incluye el desarrollo de complicaciones como encefalopatía, pericarditis, hemorragia, disfunción endotelial, carbamilación de proteínas, alteración de la barrera intestinal, aterosclerosis y se asocia a mortalidad [3]. Estudios previos indicaron que la propia urea inducía cambios moleculares relacionados con la resistencia a la insulina, la producción de radicales libres, la apoptosis y la alteración de la barrera intestinal con generación de disbiosis. Además, la urea promueve la sintesis de cianatos, de compuestos amoniacales y carbamilados, todos ellos relacionados con cambios biológicos negativos. La carbamilación se ha considerado responsable de las modificaciones postraduccionales de las proteínas que están involucradas en la aterogénesis y otros cambios funcionales vasculares. En estudios clínicos observacionales, estos compuestos carbamilados se asociaron con morbilidad y mortalidad cardiovascular. Sin embargo, no se puede responsabilizar a la urea de todos los complejos cambios metabólicos y clínicos observados en el síndrome urémico [2]. Es importante tener en cuenta que las asociaciones clínicas de la urea y sus compuestos relacionados no siempre se han informado de manera consistente [4]. Durante la injuria renal aguda (IRA), la elevación de urea es casi universal [5], aunque no siempre es secundario a una disfunción renal. En pacientes críticos puede deberse a múltiples causas, como hemorragia intestinal alta, hipercatabolismo, hipovolemia o medicamentos [6]. Debido a la asociación entre la ureamia y las complicaciones clínicas en pacientes con IRA, es razonable considerar que la disminución de sus niveles podría ir acompañada de mejores resultados clínicos. Por este motivo, se han realizado varios intentos en el contexto de la IRA [7]. La nueva evidencia incluso sugiere que existe un beneficio en mortalidad cuando se inicia terapia de reemplazo renal (TRR) durante la IRA frente a valores altos de urea/BUN [8] (ver Tabla). Históricamente, la disminución de los valores de urea es uno de los principales objetivos en el manejo de los pacientes con enfermedad renal crónica (ERC) e IRA, a pesar de la escasa evidencia que apoya esta práctica. Las guías KDIGO consideran un valor alto de urea como una razón potencial para considerar iniciar TRR, aunque no hay un valor de urea específico para guiar esta decisión [12]. Diferentes estudios [8] [9] han sugerido valores de urea ~40 mmol/L (~240 mg/dL) como umbrales para considerar iniciar TRR en IRA, sin ser una práctica estandarizada [5]. Es razonable pensar que en el IRA la reducción de la urea podría tener efectos positivos como limitar la pericarditis con la consiguiente mejoría cardiovascular [13], tratar la encefalopatía y aumentar la capacidad neurológica con posibilidad de extubación [14], cambiar la disbiosis intestinal secundario a disminuir la inflamación [15] y como tratamiento del sangrado urémico [16]. Todas estas circunstancias pueden coexistir en pacientes críticos, y en la actualidad no existen tratamientos específicos para estas complicaciones salvo las terapias de reemplazo renal (TRR).
Tabla. Estudios que han considerado niveles sericos de urea en sangre como criterios de TRR
| Estudio | Año | Urea serica considerada para inicio de TRR |
| Zarbock y otros. [9] | 2016 | Urea serica >100 mg/dL (35.7 mmol/L) |
| Gaudry y otros.[8] | 2016 | Urea serica >112 mg/dL (40 mmol/L) |
| Combes y otros. | 2015 | Urea serica >36 mmol/L |
| Jamale y otros. | 2013 | Nausea urémica |
| Bagshaw y otros | 2009 | Urea serica >24.2 mmol/L |
| Bouman y otros. | 2002 | Urea serica >40 mmol/L |
| Pursnani y otros. | 1997 | Urea serica >40 mmol/L |
Un deficit en la reducción de urea en IRA pudiera explicarse en aquellos que habían recibido un TRR inadecuado, aumentando el riesgo de muerte [17]. Categorizar a estos pacientes como “urémicos” podría estar influenciada por el dogma histórico existente [2] y las recomendaciones de la guía KDIGO de iniciar TRR en presencia de esta complicación [12].
Decidir qué modalidad de TRR es la más efectiva para lograr una reducción de urea efectiva y rápida, es motivo de debate. La hemodialisis (HD) intermitente reduce los niveles rapidamente, la dialisis peritoneal puede ser un poco más lenta al igual que las terapias de reemplazo renal continuas extracorporeas, por tal motivo se preferiria HD ante una urgencia urémica, pero no existe una evidencia contundente que sustente esta decisión. Lo cual es consistente con publicaciones previas que han demostrado que todas las modalidades, bien realizadas, son igualmente efectivas para reducir la urea [18, 19]. Inclusive la reducción rápida de urea en en pacientes uremicos provoca el síndrome postdáilisis o síndrome de desequilibrio intradiálisis, que fisiopatologicamente, se explica por edema cerebral provocado por los cambios osmóticos asociados a la reduccion abrupta de urea.
En contexto de IRA, se observan elevaciones muy altas de urea en nefropatía obstructiva, la que conocida como un diagnóstico con alto potencial de resolución eficaz y rápida tras la reversión de la obstrucción urinaria [20]. Otro escenario de IRA con elevaciones abruptas son las consideradas “prerrenal” donde la hipovolemia verdadera genera mayor absorcion tubular de urea, ademas de facilitarse esta reabsorcion debido la integridad de las celulas tubulares. El manejo de volumen intravascular es primiordial y la recuperación renal, sin necesidad de TRR que ocurre en enfermedades menos graves y, por lo tanto, se asocia con una menor mortalidad [21].
Vale la pena mencionar que en el contexto de pacientes con ERC Grado 5 en diálisis, no se ha demostrado beneficio en la reducción de la urea. La diálisis intensiva en pacientes crónicos, como se estudió en los ensayos controlados aleatorizados [22, 23, 24], mejoró significativamente el aclaramiento de urea pero no impactó positivamente la mortalidad. Sin embargo, los pacientes con ERC G5 difieren fisiológicamente de los pacientes con IRA y esas conclusiones no deben extrapolarse. Para aportar datos adicionales a este tema tan controvertido, exploramos la asociación entre la reducción de los valores de urea en pacientes hospitalizados con IRA y la mortalidad. De manera retrospectiva, analizamos 651 pacientes, encontramos que una mayor magnitud en la reducción de la urea durante los primeros 10 días de hospitalización, se asoció a mejor sobrevida, y que en aquellos que no alcanzaron al menos una reducion del 25% del valor basal, se incremenó el riesgo de muerte significativamente (ASN Kidney Week 2022 Poster TH-P045, en vías de publicación) por lo que creemos que es un tema que merece mas interés.
REFERENCIAS
- Almeras C, Argilés A. The general picture of uremia. Semin Dial. 2009 Jul-Aug;22(4):329-33. doi: 10.1111/j.1525-139X.2009.00575.x. PMID: 19708976.
- Vanholder R, Gryp T, Glorieux G. Urea and chronic kidney disease: the comeback of the century? (in uraemia research). Nephrol Dial Transplant. 2018 Jan 1;33(1):4-12. doi: 10.1093/ndt/gfx039. PMID: 28407121.
- do Nascimento, G. V., Balbi, A. L., Ponce, D., & Abrão, J. M. (2012). Early initiation of dialysis: mortality and renal function recovery in acute kidney injury patients. Jornal brasileiro de nefrologia : ‘orgao oficial de Sociedades Brasileira e Latino-Americana de Nefrologia, 34(4), 337–342. https://doi.org/10.5935/0101-2800.20120022
- Duranton F, Cohen G, De Smet R, Rodriguez M, Jankowski J, Vanholder R, Argiles A; European Uremic Toxin Work Group. Normal and pathologic concentrations of uremic toxins. J Am Soc Nephrol. 2012 Jul;23(7):1258-70. doi: 10.1681/ASN.2011121175. Epub 2012 May 24. Erratum in: J Am Soc Nephrol. 2013 Dec;24(12):2127-9. PMID: 22626821; PMCID: PMC3380651.
- Mackenzie J, Chacko B. An isolated elevation in blood urea level is not ‘uraemia’ and not an indication for renal replacement therapy in the ICU. Crit Care. 2017 Nov 13;21(1):275. doi: 10.1186/s13054-017-1868-x. PMID: 29132411; PMCID: PMC5683443.
- Verdier V, Soulage CO, Koppe L. New clinical evidence for urea toxicity. Nephrol Dial Transplant. 2021 Dec 31;37(1):1-4. doi: 10.1093/ndt/gfab269. PMID: 34519782.
- Gibney N, Hoste E, Burdmann EA, Bunchman T, Kher V, Viswanathan R, Mehta RL, Ronco C. Timing of initiation and discontinuation of renal replacement therapy in AKI: unanswered key questions. Clin J Am Soc Nephrol. 2008 May;3(3):876-80. doi: 10.2215/CJN.04871107. Epub 2008 Mar 5. PMID: 18322044.
- Gaudry S, Hajage D, Martin-Lefevre L, Lebbah S, Louis G, Moschietto S, Titeca-Beauport D, Combe B, Pons B, de Prost N, Besset S, Combes A, Robine A, Beuzelin M, Badie J, Chevrel G, Bohé J, Coupez E, Chudeau N, Barbar S, Vinsonneau C, Forel JM, Thevenin D, Boulet E, Lakhal K, Aissaoui N, Grange S, Leone M, Lacave G, Nseir S, Poirson F, Mayaux J, Asehnoune K, Geri G, Klouche K, Thiery G, Argaud L, Rozec B, Cadoz C, Andreu P, Reignier J, Ricard JD, Quenot JP, Dreyfuss D. Comparison of two delayed strategies for renal replacement therapy initiation for severe acute kidney injury (AKIKI 2): a multicentre, open-label, randomised, controlled trial. Lancet. 2021 Apr 3;397(10281):1293-1300. doi: 10.1016/S0140-6736(21)00350-0. PMID: 33812488.
- Zarbock A, Kellum JA, Schmidt C, et al. Effect of early vs delayed initiation of
renal replacement therapy on mortality in critically ill patients with acute
kidney injury: the ELAIN Randomized Clinical Trial. JAMA. 2016;315:2190.
- Kellum J.A., Lameire N., Aspelin P., Barsoum R.S., Burdmann E.A., Goldstein S.L., Herzog C.A., (…), Uchino S. Kidney disease: Improving global outcomes (KDIGO) acute kidney injury work group. KDIGO clinical practice guideline for acute kidney injury (2012) Kidney International Supplements, 2 (1), pp. 1-138.
- Von Elm E, Altman DG, Egger M, Pocock SJ, Gøtzsche PC, Vandenbroucke JP, et. The Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: guidelines for reporting observational studies]. Rev Esp Salud Publica. 2008;82(3):251-9.
- Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Workgroup. KDIGO clinical practice guideline for acute kidney injury. Kidney Int Suppl. 2012; 2:1–138.
- Chugh S, Singh J, Kichloo A, Gupta S, Katchi T, Solanki S. Uremic- and Dialysis-Associated Pericarditis. Cardiol Rev. 2021 Nov-Dec 01;29(6):310-313. doi: 10.1097/CRD.0000000000000381. PMID: 33337656.
- Seifter JL, Samuels MA. Uremic encephalopathy and other brain disorders associated with renal failure. Semin Neurol. 2011 Apr;31(2):139-43. doi: 10.1055/s-0031-1277984. Epub 2011 May 17. PMID: 21590619.
- Rydzewska-Rosołowska A, Sroka N, Kakareko K, Rosołowski M, Zbroch E, Hryszko T. The Links between Microbiome and Uremic Toxins in Acute Kidney Injury: Beyond Gut Feeling-A Systematic Review. Toxins (Basel). 2020 Dec 11;12(12):788. doi: 10.3390/toxins12120788. PMID: 33322362; PMCID: PMC7764335.
- Galbusera M, Remuzzi G, Boccardo P. Treatment of bleeding in dialysis patients. Semin Dial. 2009 May-Jun;22(3):279-86. doi: 10.1111/j.1525-139X.2008.00556.x. PMID: 19573008.
- Gunst J, Kashani KB, Hermans G. The urea-creatinine ratio as a novel biomarker of critical illness-associated catabolism. Intensive Care Med. 2019 Dec;45(12):1813-1815. doi: 10.1007/s00134-019-05810-y. Epub 2019 Oct 16. PMID: 31620835.
- Gabriel DP, Caramori JT, Martim LC, Barretti P, Balbi AL. High volume peritoneal dialysis vs daily hemodialysis: a randomized, controlled trial in patients with acute kidney injury. Kidney Int Suppl. 2008 Apr;(108):S87-93. doi: 10.1038/sj.ki.5002608. PMID: 18379555.
- Ponce D, Berbel MN, Abrão JM, Goes CR, Balbi AL. A randomized clinical trial of high volume peritoneal dialysis versus extended daily hemodialysis for acute kidney injury patients. Int Urol Nephrol. 2013 Jun;45(3):869-78. doi: 10.1007/s11255-012-0301-2. Epub 2012 Oct 12. PMID: 23065432.
- Chávez-Iñiguez JS, Navarro-Gallardo GJ, Medina-González R, Alcantar-Vallin L, García-García G. Acute Kidney Injury Caused by Obstructive Nephropathy. Int J Nephrol. 2020 Nov 29;2020:8846622. doi: 10.1155/2020/8846622. PMID: 33312728; PMCID: PMC7719507.
- Forni LG, Darmon M, Ostermann M, Oudemans-van Straaten HM, Pettilä V, Prowle JR, Schetz M, Joannidis M. Renal recovery after acute kidney injury. Intensive Care Med. 2017 Jun;43(6):855-866. doi: 10.1007/s00134-017-4809-x. Epub 2017 May 2. PMID: 28466146; PMCID: PMC5487594.
- Depner T, Beck G, Daugirdas J, Kusek J, Eknoyan G. Lessons from the Hemodialysis (HEMO) Study: an improved measure of the actual hemodialysis dose. Am J Kidney Dis. 1999 Jan;33(1):142-9. doi: 10.1016/s0272-6386(99)70272-6. PMID: 9915282.
- Paniagua R, Amato D, Vonesh E, Correa-Rotter R, Ramos A, Moran J, Mujais S. Effects of increased peritoneal clearances on mortality rates in peritoneal dialysis: ADEMEX, a prospective, randomized, controlled trial. J Am Soc Nephrol. 2002 May;13(5):1307-1320. doi: 10.1681/ASN.V1351307. PMID: 11961019.
FHN Trial Group, Chertow GM, Levin NW, Beck GJ, Depner TA, Eggers PW, Gassman JJ, Gorodetskaya I, Greene T, James S, Larive B, Lindsay RM, Mehta RL, Miller B, Ornt DB, Rajagopalan S, Rastogi A, Rocco MV, Schiller B, Sergeyeva O, Schulman G, Ting GO, Unruh ML, Star RA, Kliger AS. In-center hemodialysis six times per week versus three times per week. N Engl J Med. 2010 Dec 9;363(24):2287-300. doi: 10.1056/NEJMoa1001593. Epub 2010 Nov 20. Erratum in: N Engl J Med. 2011 Jan 6;364(1):93. PMID: 21091062; PMCID: PMC3042140

No hay comentarios