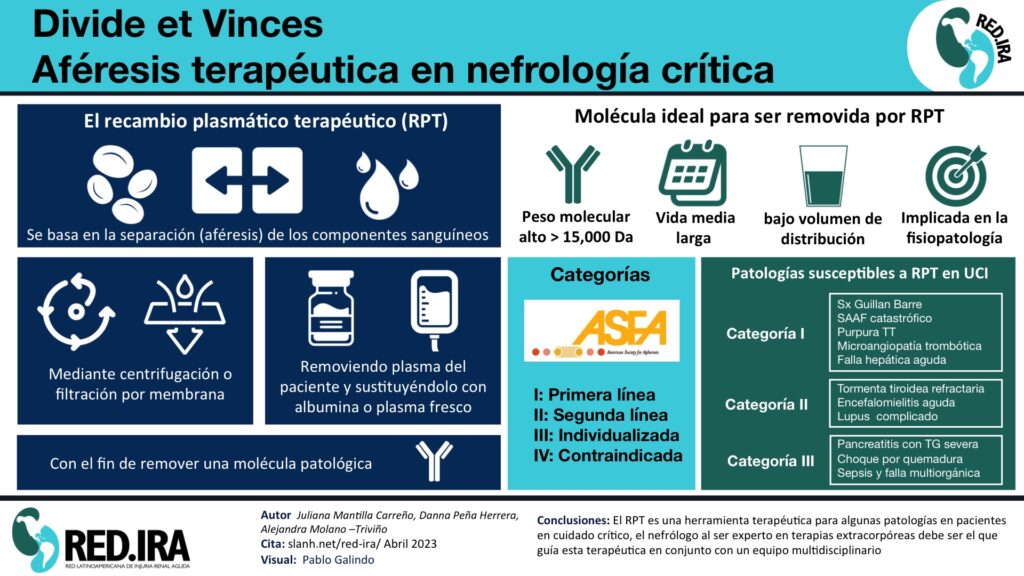
Divide et Vinces. Aféresis terapéutica en nefrología crítica.
Juliana Mantilla Carreño1, Danna Peña Herrera1, Alejandra Molano -Triviño1,2,3.
- Universidad del Rosario, Bogotá, Colombia, Escuela de Medicina y Ciencias de la Salud
- Nephrology, La Cardio, Bogotá, Colombia
- International Renal Research Institute Vicenza, Italy
El recambio plasmático terapéutico (RPT), frecuentemente conocido como Plasmaféresis, se basa en la separación (aféresis) de los componentes sanguíneos mediante centrifugación o por filtración por membrana.
Ambas modalidades permiten la separación del plasma, respetando los elementos celulares, tras lo cual el volumen de plasma separado y extraído es reemplazado por el mismo volumen de una solución de reemplazo como plasma fresco o albúmina 5%, Una vez se separa y se descarta el plasma de los componentes celulares sanguíneos, estos son retornados al paciente y el líquido de sustitución es infundido por una bomba en el mismo volumen que se extrajo. (1)
Las indicaciones para realizar RPT son diversas y frecuentemente atañen a diferentes especialidades co-tratantes. La sociedad Americana de Aféresis terapéutica (ASFA), en sus guías de recomendaciones basadas en la evidencia, proveen periódicamente de indicaciones acerca del uso de RPT en varias enfermedades, muchas de ellas de alta letalidad, frecuentemente manejadas en cuidado crítico y que se resumen en la tabla 1(1) (2) (3)
Tabla 1. Patologías susceptibles de manejo con RPT en Cuidado crítico (3)
|
Entidad |
Racional |
Líquido de reposición recomendado por ASFA |
Grado de recomendación ASFA |
|
Síndrome de Guillain Barré |
Remoción de anticuerpos |
Albúmina o plasma |
categoría I, grado 1A |
|
Síndrome antifosfolípidos catastrófico |
Remoción de anticuerpos, citoquinas, complemento y administración de factores de coagulación deficientes. Coadyuvante de esteroides, anticoagulantes e inmunoglobulinas. |
Plasma |
categoría I, grado 2C |
|
Miastenia gravis |
Remoción de autoanticuerpos e inmunomodulación, coadyuvante con corticosteroides, Inmunoglobulinas, timectomía, eculizumab |
Albúmina |
Aguda: categoría I, grado 1B. Mantenimiento, tratamiento de recaídas: categoría II, grado 2B |
|
Púrpura trombocitopénica Trombótica |
Administración de proteasa de ADAMTS13 y remoción de autoanticuerpos anti ADAMTS 13. Coadyuvante con corticosteroides, caplacizumab |
Plasma |
categoría I, grado 1A |
|
Microangiopatía trombótica mediada por complemento: Síndrome hemolítico urémico atípico (SHUA) |
Primera estrategia terapéutica mientras se estudia etiología y se inicia eculizumab |
Plasma |
categoría I, grado 2C |
|
Falla hepática Aguda |
Remoción de toxinas unidas a albúmina e hidrosolubles, reemplazo de proteínas plasmáticas, incluyendo factores de coagulación, inmunomodulación. Terapia de soporte multiorgánico puente a trasplante hepático. |
Plasma |
RPT de alto volumen categoría I, grado 1A, RPT categoría III, grado 2B |
|
Tormenta tiroidea refractaria |
Remoción de anticuerpos, catecolaminas y citoquinas, coadyuvante con corticosteroides, betabloqueadores, propiltiouracilo |
Plasma, albúmina |
categoría II, grado 2C |
|
Encefalomielitis aguda diseminada |
Remoción de autoanticuerpos, coadyuvante con corticosteroides e inmunoglobulinas. |
Albúmina |
categoría II, grado 2C |
|
Pancreatitis con hipertrigliceridemia severa |
Disminución de trigliceridemia, remoción de citoquinas inflamatorias y reemplazo de lipasas deficientes. |
Albúmina, plasma |
Severa: categoría III, grado 1C Prevención de recaída categoría III, grado 2C |
|
Envenenamientos específicos |
Remoción de sustancias tóxicas con alta unión a proteínas y bajo volumen de distribución: Paraquat, envenenamiento por hongos |
Albúmina, plasma |
Envenenamiento por hongos: categoría II, grado 2C Envenenamientos o sobredosis por tóxicos de unión a proteínas alta: categoría III, grado 2C |
|
Lupus eritematoso sistémico severo con complicaciones vasculíticas: cerebritis y neumonitis |
Remoción de autoanticuerpos, coadyuvante con inmunosupresión |
Albúmina, plasma |
categoría II, grado 2C |
|
Resucitación de choque por quemadura |
Remoción de factores circulantes inflamatorios. El uso de plasma puede disminuir la permeabilidad capilar y mejorar la presión oncótica intravascular: mejor respuesta a resucitación con cristaloides. |
Albúmina, plasma |
categoría III, grado 2B |
|
Sepsis con falla multiorgánica |
Remoción de mediadores inflamatorios y antifibrinolíticos y reposición de proteínas anticoagulantes y ADAMTS13. Evidencia creciente en combinación con adsorción y convectivas |
plasma |
categoría III, grado 2B |
Consideramos que el RPT debe ser realizado por nefrólogos y enfermeras de nefrología, dada la experiencia en el uso de membranas de purificación sanguínea, el manejo de acceso vascular, además del conocimiento de los circuitos extracorpóreos. (1) (3)
El RPT se basa en dos principios fundamentales: (1) (2)
- Adicionar a la sangre del paciente, elementos faltantes que generen la patología, por ejemplo, adición de ADAMTS-13 en la púrpura trombocitopénica trombótica.
- Remover sustancias de la sangre, potencialmente implicadas en la fisiopatología de varias enfermedades, con la intención de revertir o frenar el proceso patológico subyacente, por ejemplo, la remoción de autoanticuerpos en la enfermedad por anticuerpos anti-membrana glomerular
Las sustancias a remover, deben cumplir con al menos una de las siguientes condiciones para ser susceptibles de ser removidas por RPT: (1) (4)
- Peso molecular alto: > 15,000 Da: con este rango, ninguna otra técnica de purificación sanguínea resulta útil.
- Vida media prolongada y tasa de formación lenta: Se pretende tener un tiempo con niveles bajos de la sustancia patogénica, favorable y suficiente para permitir la mejoría del mecanismo causal
- Las moléculas objetivo debe tener un bajo recambio y bajo volumen de distribución.
- La sustancia debe estar implicada en los mecanismos fisiopatológicos de la enfermedad, por ejemplo, remoción de Paraquat para el manejo de intoxicación y sus efectos sistémicos
Adicionalmente, se han descrito otros efectos beneficiosos del RPT como el estímulo del sistema reticuloendotelial y el efecto inmunomodulador asociado a la depuración de interleucinas o el factor de necrosis tumoral, lo cual resulta de especial interés en patologías manejadas en UCI como sepsis severa. (4)
Para incrementar el beneficio terapéutico de la remoción de moléculas nocivas, es necesario asociar tratamiento modulador de su producción como por ejemplo con inmunosupresores que frenen la producción de nuevos anticuerpos
La aféresis de RPT puede hacerse con centrífuga, que se realiza con un dispositivo de centrifugación similar a los usados en los bancos de sangre. Clásicamente se ha descrito que la aféresis por centrifugación puede realizarse con acceso vascular periférico, sin embargo, suele requerirse acceso venoso central en más del 30% de los pacientes, sobre todo dependiendo del volumen de plasma a tratar o de la necesidad de manejo en cuidado crítico. (2) (4)
Con la técnica de separación por membrana, se usa un filtro de alta permeabilidad hecho con fibras de poros grandes (0.3–0.5 mm), acoplado a una máquina de diálisis, que provee un flujo sanguíneo constante (50-200 ml/min), filtra el plasma a un ultrafiltrado conocido como plasmafiltro que contiene todos los componentes no celulares del plasma del paciente y retorna las células sanguíneas unidas a un líquido de reposición simultáneamente adicionado al circuito sanguíneo. (4)
La aféresis no es selectiva, por ende, conlleva el efecto indeseado de la pérdida de sustancias “inocentes” no implicadas en la patología o incluso benéficas. Por ejemplo, con el RPT hay remoción involuntaria de factores de coagulación, con riesgo de sangrado inherente, por lo que se precisa reponer los factores de coagulación para evitar efectos adversos. (1) (4)
La aféresis y remoción de un volumen determinado de plasma afectado implica variaciones del volumen intravascular que deben ser corregidos simultáneamente para evitar inestabilidad hemodinámica. Las diferentes tecnologías de RPT están programadas para la reposición simultánea del volumen extraído de plasma en la misma cantidad, para mantener estabilidad hemodinámica del paciente.
Para corregir las variaciones de la volemia y las sustancias perdidas colateralmente, se emplea el líquido de reposición con un fluido que puede ser albúmina o plasma fresco, que se elige de acuerdo a la fisiopatología de cada patología acorde a recomendaciones reunidas en las guías de ASFA. (1), (5)
En algunos casos, se prefiere el plasma fresco al proveer los componentes no celulares de la sangre previamente removidos en el RPT, corrigiendo la coagulopatía, esto es especialmente relevante en patologías con riesgo de sangrado o con deficiencia de un componente del plasma, por ejemplo, en púrpura trombocitopénica trombótica (asociada con deficiencia de ADAMTS13) (3)
La albúmina es el líquido de sustitución para RPT más frecuentemente indicado en las guías de ASFA, brindando menor riesgo de potencial transmisión de infecciones relacionadas con la donación o con reacciones anafilácticas. Sin embargo, implica potencialmente coagulopatía post RPT dada la ausencia de factores de coagulación en la albúmina. Se usa en concentración al 5% para resultar iso-osmótica al plasma, como una estrategia de mantenimiento de la presión oncótica del plasma removido (3) (4).
En pacientes con patologías de alta letalidad, como sepsis y falla hepática, se postula en los últimos años el potencial beneficio de la asociación de la aféresis de la RPT con otros mecanismos de purificación sanguínea como la convección y la adsorción. Es así, que el RPT membranal hace acopio de su compatibilidad técnica y con terapias de adsorción y con TRRC, añadiendo la capacidad de depuración de moléculas unidas a proteínas a un sorbente o cartucho de hemoperfusión, como estrategias de soporte multiorgánico. (5)
En la asociación de plasmafiltración con adsorción (PFAD), el plasma se separa de la sangre y es circulada a través del sorbente y reinfundido en el circuito. El plasma separado por el filtro, pasa por un cartucho de adsorción con afinidad para moléculas específicas y es retornado al paciente. Esta modalidad tiene la ventaja de eliminar inmunoglobulinas y complejos inmunes, sin la necesidad de emplear sustitución con plasma humano. Su uso está recomendado por guías como la 8va edición de la ASFA o las de la sociedad alemana de neurología. (1) (5)
Cuando se acopla el PFAD con un dializador: con hemodiálisis intermitente (PFAD-HD) o con terapia de reemplazo renal continua (CPFA-CRRT) se combinan 3 técnicas: convección, difusión y adsorción, que expanden la eficiencia del tratamiento. (5)
Otra variación de combinación de RPT es la doble plasmafiltración acoplada a sistema de adsorción molecular (DPMAS) que se puede emplear en falla hepática y renal. Emplea sorbentes específicos para toxinas hepáticas acoplados al circuito de RPT. (5)
En la figura 1, se representan las modalidades de RPT y sus potenciales combinaciones para soporte multisistémico.
Figura 1. Modalidades de RPT para soporte multisistémico.
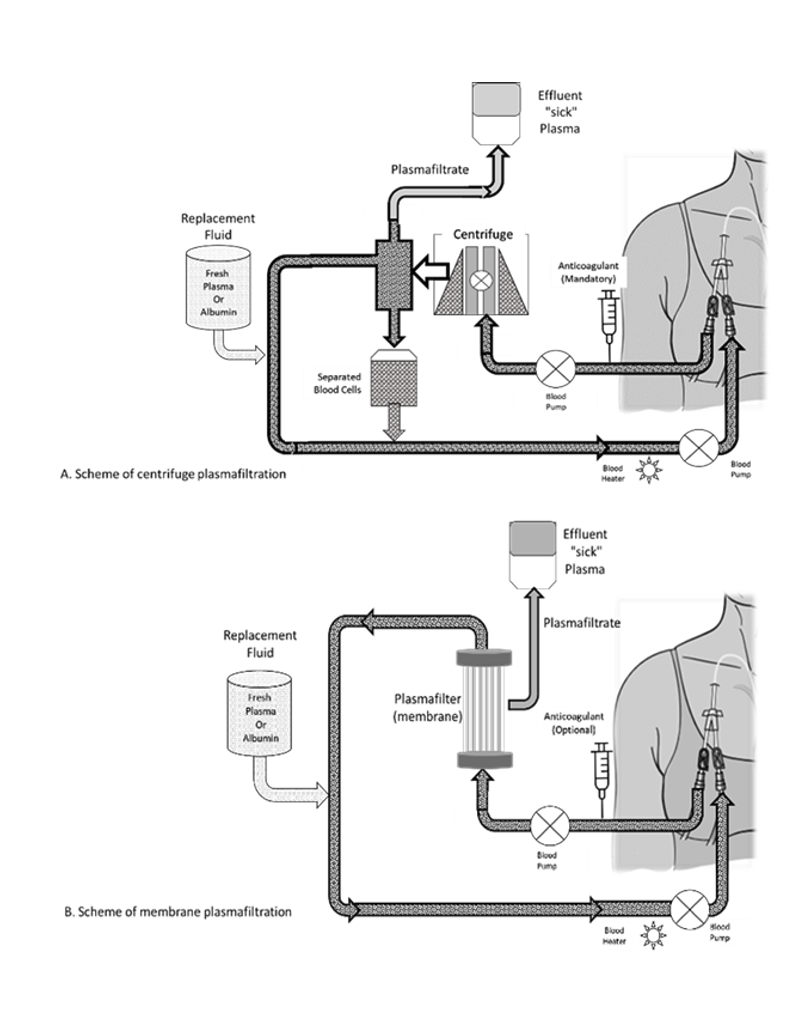
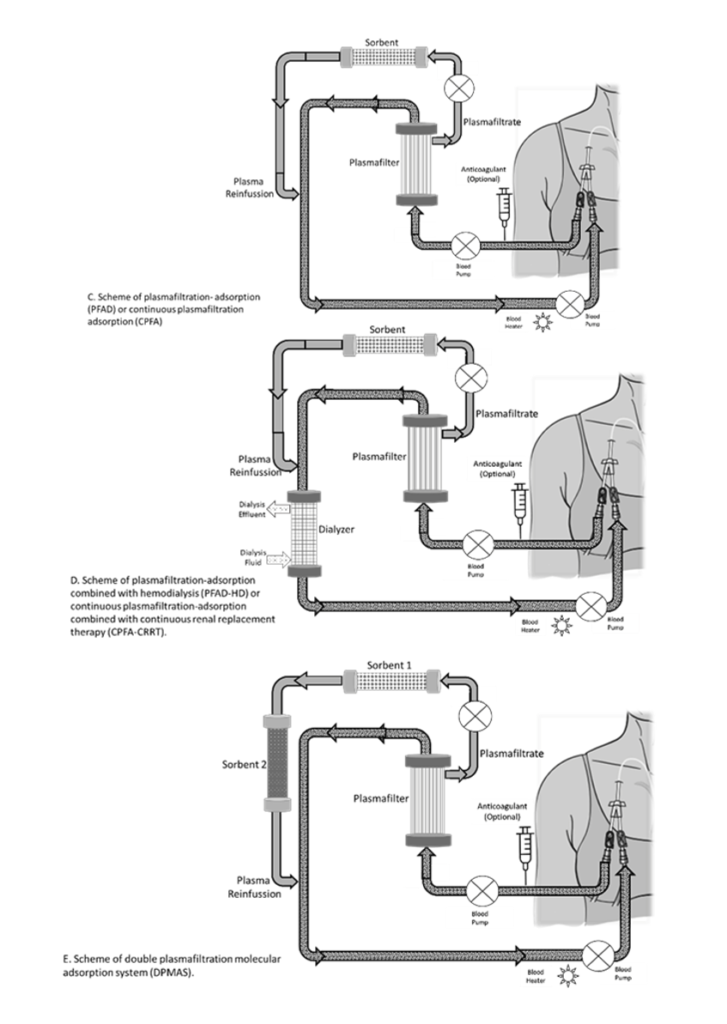
Los circuitos de RPT pueden preservarse con heparina o citrato como cualquier circuito extracorpóreo, acorde a recomendaciones de guías KDIGO, siempre individualizando la indicación de acuerdo al riesgo de sangrado o complicaciones de cada paciente. (3) Es posible la preservación del circuito sin el uso de anticoagulación, con lavados con cristaloides del circuito y ajuste de la fracción de filtrado, aminorando la exposición a medicación adicional de los pacientes. En nuestro centro, con esta estrategia, de no usar anticoagulante, tenemos menos de 1% de coagulación de los filtros (datos aceptados para publicación para ASFA 2023 annual meeting).
Nuestra experiencia
En nuestro hospital, institución de cuarto nivel en Bogotá, Colombia, realizamos RPT membranal en un modelo “nefrocéntrico” en el que nefrología gesta la discusión de cada paciente con indicación de RPT con las distintas especialidades médicas en una junta médica, para determinar objetivos, definir duración de la terapia, planificar el sitio de realización de la terapia y hacer revisión conjunta de las estrategias terapéuticas adicionales a instaurar.
Si bien el RPT clásicamente se realizaba en la unidad de cuidado crítico, en nuestro centro lo realizamos de acuerdo a criterios de complejidad de cada paciente, en la UCI o en una sala de RPT (“plasmacentro”) en modalidad de hospital día, por ejemplo, para pacientes con necesidad de RPT prolongada como, por ejemplo, el caso de pacientes con rechazo mediado por anticuerpos de trasplante de órganos, que son citados de acuerdo a ASFA dos o tres veces por semana.
En la UCI, se realiza el RPT a los pacientes críticamente enfermos o con necesidad de monitorización de cambios clínicos significativos, como por ejemplo con patologías neurológicas con riesgo de progresión como síndrome de Guillain Barré.
En un análisis reciente de nuestra base de datos, pendientes de publicación, entre octubre de 2021 y octubre de 2022, realizamos 384 sesiones de RPT a 44 pacientes (promedio 6 sesiones por paciente). En el modelo de hospital día se realizaron 238 sesiones (62%); hasta el año 2021 realizábamos 100% de los casos en UCI. Consideramos diversificar el sitio de realización de RPT, una estrategia que ha permitido tener más disponibilidad de camas de UCI para pacientes con clara indicación de cuidado crítico y no solo para la realización de RPT. Además, aunque no era un objetivo principal de nuestro análisis, encontramos eficiencias económicas de 30% del costo total del RPT: costo promedio de RPT en UCI es de € 980 vs € 758 en el plasmacentro.
Compartimos nuestro modelo como una iniciativa potencialmente replicable en nuestro escenario latinoamericano para acercar el RPT a poblaciones con altas carencias de cuidado crítico y potencialmente incrementar su uso para diferentes patologías de distintas especialidades con un enfoque holístico de nefrología.
Referencias
- Ahmed S, Kaplan A. Therapeutic Plasma Exchange Using Membrane Plasma Separation. Clin J Am Soc Nephrol CJASN. 7 de septiembre de 2020;15(9):1364-70.
- Bauer PR, Ostermann M, et al, Plasma exchange in the intensive care unit: a narrative review. Intensive Care Med. 2022 Oct;48(10):1382-1396. doi: 10.1007/s00134-022-06793-z. Epub 2022 Aug 12. PMID: 35960275; PMCID: PMC9372988.
- Padmanabhan A, Connelly-Smith L, et al. Guidelines on the Use of Therapeutic Apheresis in Clinical Practice – Evidence-Based Approach from the Writing Committee of the American Society for Apheresis: The Eighth Special Issue. J Clin Apheresis. 2019;34(3):171-354.
- Kaplan AA. Therapeutic plasma exchange: A technical and operational review. J Clin Apheresis. 2013;28(1):3-10.
- Ronco C, Bellomo R. Hemoperfusion: technical aspects and state of the art. Crit Care. 12 de mayo de 2022;26(1):135.

No hay comentarios